X
Звонки для Украины
Звонки для Европы
Звонки для США
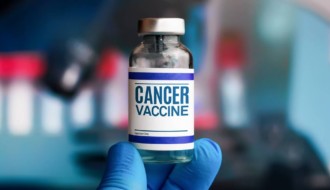
В США одобрили генную клеточную терапию для лечения лимфомы
Безопасность и эффективность клеточной терапии Breyanzi были установлены в многоцентровом клиническом исследовании с участием более 250 взрослых с В-крупноклеточной лимфомой.
Частота полной ремиссии после лечения Breyanzi составила 54%.
Хотите получить бесплатную консультацию?
Получить консультацию
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило Breyanzi (lisocabtagene maraleucel) — клеточную генную терапию для лечения взрослых пациентов с определенными типами В-крупноклеточной лимфомы, которые не ответили на лечение или у которых возник рецидив после как минимум двух других видов системного лечения.
Инновационное лечение
Breyanzi, Т-клеточная терапия с использованием химерного антигенного рецептора (CAR), является третьей генной терапией, одобренной FDA для некоторых типов неходжкинской лимфомы, включая диффузную В-крупноклеточную лимфому (DLBCL).

«Этот следующий шаг в быстро развивающейся области генной терапии предоставляет дополнительный вариант лечения для взрослых с определенными типами рака, поражающими кровь, костный мозг и лимфатические узлы. Генная и клеточная терапия превратились из многообещающих концепций в практические схемы лечения рака», — Питер Маркс, доктор медицины, доктор философии, директор Центра оценки и исследований биологических препаратов FDA.
DLBCL — наиболее распространенный тип неходжкинской лимфомы у взрослых.
Неходжкинская лимфома — это рак, который начинается в определенных клетках иммунной системы и может быть быстрорастущим (агрессивным) или медленнорастущим. Приблизительно 77000 новых случаев неходжкинской лимфомы диагностируются в США каждый год, а DLBCL составляет примерно каждый третий впервые диагностированный случай.
Каждая доза Breyanzi — это индивидуальное лечение, созданное с использованием собственных Т-клеток пациента, типа белых кровяных телец, для борьбы с лимфомой.
Т-клетки пациента собираются и генетически модифицируются, чтобы включить новый ген, который облегчает нацеливание и уничтожение клеток лимфомы. Как только клетки изменены, они снова вводятся пациенту.
Обратная сторона лечения
Лечение Breyanzi может вызвать некоторые побочные эффекты. Маркировка содержит предупреждение о синдроме высвобождения цитокинов (CRS), который является системным ответом на активацию и пролиферацию CAR T-клеток, вызывая высокую температуру, гриппоподобные симптомы и неврологическую токсичность. Побочные эффекты обычно появляются в течение первых двух недель после лечения.
Из-за риска неврологической токсичности Breyanzi одобряется со стратегией оценки и снижения риска (REMS), которая включает элементы для обеспечения безопасного использования (ETASU). Помимо прочего, FDA требует, чтобы медицинские учреждения, выдающие Breyanzi, были специально сертифицированы. В рамках этой сертификации персонал, участвующий в назначении, выдаче или введении Breyanzi, должен быть обучен распознаванию и управлению рисками.

Прорывная терапия
Не смотря на возможные побочные эффекты, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США назвало Breyanzi улучшенной терапией регенеративной медицины (RMAT) и прорывной терапий.
Breyanzi — это первая терапия регенеративной медицины с обозначением RMAT, лицензированная FDA.
Программа обозначения RMAT была создана в соответствии с Законом о лечении 21 века, чтобы помочь ускорить разработку методов регенеративной медицины, предназначенных для лечения серьезных заболеваний.
Ищете сертифицированные клиники по онкологии и гематологии?
Подобрать больницу
Примечательно, что в Украине регенеративная медицина одобрена, а сертифицированные клиники имеют более 20 лет опыта в лечении генной клеточной терапией и ежегодно спасают жизни тисячам пациентов со всего мира.
Источник:
https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-adults-relapsed-or-refractory-large-b-cell-lymphoma
Категории:
Новости медицины
Темы:
Все категории:
- Война (11)
- Заболевания (6)
- Интервью с докторами (22)
- Медицинские статьи (97)
- Новости медицины (334)
Появились вопросы?
Получите бесплатную консультацию от наших специалистов