X
Звонки для Украины
Звонки для Европы
Звонки для США
Получено финансирование на разработку инновационной вакцины от деменции
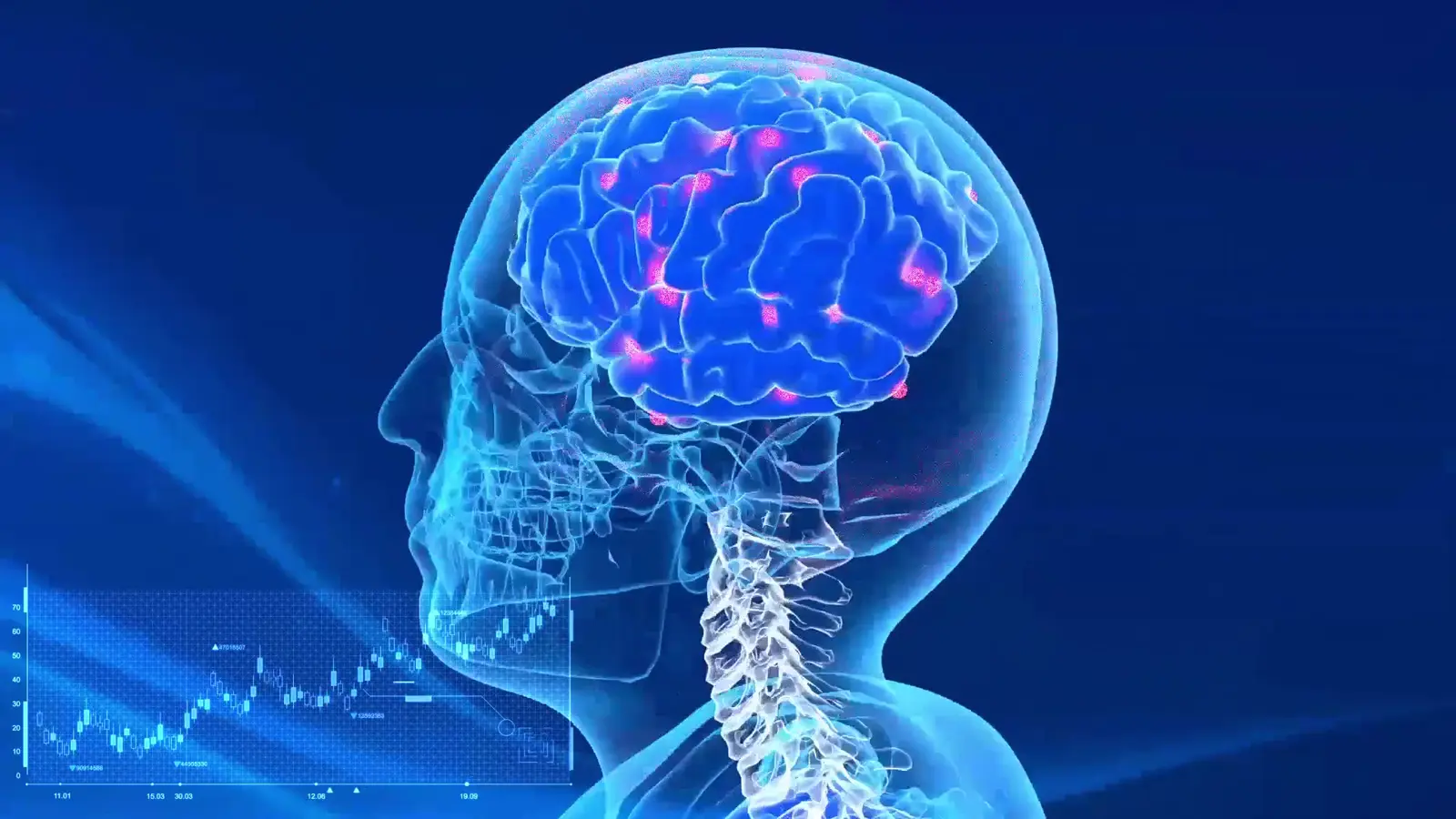
Болезнь Альцгеймера и лобно-височная деменция – разрушительные заболевания, возникающие после накопления в головном мозге неправильно сформированных белков.
Новейшее поколение препаратов для лечения болезни Альцгеймера нацелено на накопление белка амилоида бета с помощью специально разработанных антител, но результаты их применения оказались не слишком впечатляющими, к тому же они имеют ряд побочных эффектов, не говоря уже о том, что использование таких антител может быть непомерно дорогим.
Болезнь Альцгеймера характеризуется накоплением в тканях головного мозга амилоидных бляшек и нейрофибриллярных клубков. Бляшки построены из бета-амилоидного пептида, который свернут в виде бета-складки. В свою очередь, нейрофибриллярные клубки состоят из специального тау-белка. В отличие от нормальных белков, амилоидные бляшки и нейрофибриллярные клубки находятся в слипшемся виде и неправильно свернуты.
Исследователи из Вашингтонского университета в Сент-Луисе используют новый подход, стремясь разработать вакцины, которые научат собственную иммунную систему человека уничтожать эти скопления амилоида бета и белка тау.
Получив грант в размере 2,9 миллиона долларов от Национального института старения, входящего в состав Национальных институтов здравоохранения (NIH), исследователи Jai Rudra (Джай Рудра), доктор философии, доцент кафедры биомедицинской инженерии в Школе инженерии Маккелви, и Meredith Jackrel (Мередит Джакрел), доктор философии, доцент кафедры химии факультета искусств и наук, разработают вакцины, вырабатывающие антитела против амилоида бета и белка тау, используя разработанную Jai Rudra платформу пептидных нановолокон для вакцин.
Ключевым фактором успеха этого проекта является разработка вакцин, не провоцирующих воспаление, поскольку борьба с хроническим воспалением, возникающим с возрастом, является постоянной проблемой в этой области.
По словам Rudra, в предыдущих испытаниях использовались сильные адъюванты вакцины, чтобы обеспечить атаку на амилоид бета, но у некоторых пациентов это вызвало побочные эффекты. Адъюванты могут гарантировать, что иммунная система будет воспринимать неправильно сложенные белки как «чужеродный материал», но возникающее при этом воспаление может нанести больше вреда, чем пользы. Вместо этого Rudra использует платформу из нановолокон, которую он разработал в ходе предыдущих исследований вакцин.
Нановолокна обладают уникальными свойствами, которые делают их привлекательными для создания антител к белкам тау и амилоиду бета, и они не вызывают воспаления, как другие адъюванты.
Невоспалительная природа этих волокон – очень хорошая стратегия.
Нановолокна работают лучше, потому что амилоид бета и белок тау представлены на поверхности нановолокон таким образом, что иммунная система не будет генерировать воспаление в ответ на их воздействие.
Джекрел и Рудра будут сотрудничать с исследователями из Вашингтонского университета для тестирования своих вакцин. Они будут испытывать вакцины на трансгенных мышах, у которых развиваются нарушения, имитирующие различные виды деменции в мозге.
Испытания вакцины будут проводиться как в качестве профилактического средства, так и для лечения после появления симптомов, хотя Рудра ожидает, что профилактическое применение будет более эффективным. Проблема с разрушением скоплений амилоида и тау-белка после появления симптомов деменции заключается в том, что может быть уже слишком поздно.
«Их разрушение будет очень сложной задачей», – говорит Рудра, отмечая, что, скорее всего, будет гораздо проще попытаться предотвратить нарастание симптомов деменции, пресекая нейровоспаление в зародыше, возможно, уже на стадии вступления людей в средний возраст.
Это также согласуется с другими инициативами Вашингтонского университета по разработке анализов крови для раннего выявления различных нейродегенеративных заболеваний. Другие проекты, не связанные с биомедицинской инженерией, направлены на применение всевозможных методов лечения и образа жизни, а не только иммунной системы.
Категории:
Новости медицины
Все категории:
- Война (11)
- Заболевания (6)
- Интервью с докторами (22)
- Медицинские статьи (97)
- Новости медицины (334)
Появились вопросы?
Получите бесплатную консультацию от наших специалистов